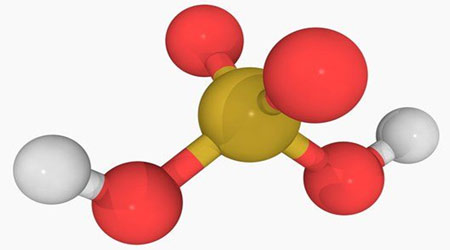
اسید سولفوریک
قبلا برای تعریف اسیدها از ویژگی های اسیدی استفاده می شد. اما با مفهوم جدیدی از اتم، تعریف متفاوتی از اسیدها به کار می رود.
مهم ترین اسید صنعتی اسید سولفوریک می باشد.
سولفوریک
اسید که در گذشته با نام جوهر گوگرد
خوانده می شد، اسیدی بسیار قوی است که با هر درصدی در آب حل می
شود و فرمول شیمیایی آن H2SO4 است. پی اچ (pH) این اسید (0/5) می باشد.
سولفوریک اسید برای نخستین بار توسط
جابربن حیان کشف شد. او با تقطیر کانی های سولفات آهن ، این اسید را به دست آورد.سولفات (II)ومس
اسید سولفوریک، اسیدی معدنی و بسیار قوی است که به طور طبیعی در گازهای خارج شده از آتشفشان وجود دارد و با هر درصدی در آب حل می شود. واکنش آن با آب به شدت گرمازا است به همین دلیل باید از اضافه کردن یک باره آب به آن اجتناب کرد. اسید سولفوریک میل ترکیبی زیادی با آب دارد به طوری که در واکنش با سایر مواد هیدروژن و اکسیژن آنها را با صورت آب جدا می کند. اسید سولفوریک خورنده است و قسمت عمده ای از باران اسیدی را تشکیل می دهد.
قطرات آب به هنگام بارش با آلاینده های کارخانه ها و خودرو ها که در هوا معلق هستند واکنش می دهند و تولید اسید می کنند. اسید سولفوریک با فلزات واکنش می دهد و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد اما بر روی جیوه و سرب تاثیری ندارد. اسید سولفوریک در لیست مواد خطرناک قرار گرفته است.
می توان
میزان صنعتی بودن کشور ها را با میزان تولید و مصرف اسید سولفوریک آنها متناسب
دانست.
اسید سولفوریک از انحلال گاز SO3
در آب بدست می آید، البته روش های
صنعتی زیادی برای تولید این اسید پر کار برد وجود دارد. (مانند روش مجاورت و روش
اتاق های سربی)
همچنین این اسید را می توان به خیلی
از اسید های دیگر تبدیل کرد، مانند نیتریک اسید، هیدروکلریک اسید،هیدروژن پروکسید
و....
روش رایج
تهیه آزمایشگاهی اسید هایی مانند نیتریک اسید(HNO3) و اسید کلریدریک (HCl)،اینگونه است که
ابتدا مقداری سولفوریک اسید را در ظرف تقطیر ریخته، نمک با یون مورد نظر (یون
کلرید،نیترات و...) را به آن اضافه کرده و بعد از بستن درب ظرف،آنرا حرارت می دهند
و اسید مورد نظر را از آن طرف ظرف، جمع آوری میکنند.
مثلا، نمک خوراکی را با اسید سولفوریک
ترکیب کرده و بعد از تقطیر، اسید هیدروکلریک تشکیل خواهد شد.
اسید سولفوریک یکی از مواد شیمیایی پر
استفاده است. این ماده در واکنش های شیمیایی و فرآیندهای تولید سایر ترکیبات
شیمیایی کاربرد بسیار زیادی دارد.
کار برد این محصول در صنایع عبارتند از:
صنایع مهمات
سازی، صنایع آبکاری، استخراج فلزات، سنتزهای شیمیایی، پالایشگاه های نفت، صنایع
باطری سازی، صنایع شوینده، صنایع کشش کاری، صنایع تولید مواد شیمیایی، صنایع تصفیه
روغن، صنایع تصفیه فاضلاب های صنعتی، صنایع نساجی، مواد شوینده، رنگ
نقاشى و دیگر صنایع کاربرد دارد.
از مهم
ترین استفاده های آن در تولید کودهای شیمیایی، صنایع شیمیایی ( ضدیخ ، حشره کش ها، دارویی، احیای
آلومینیوم) صنعت
آهن و فولاد، پاک کننده های مصنوعی، اسیدی کردن چاه های نفت،
جداسازی مس با عیار کم، استخراج اورانیوم، چسب مصنوعی ( مواد
رنگی (نایلون رنگی، جوهر تحریر و تهیه Tio2 از ایلمنیت) ابریشم مصنوعی و فیلم (
پارچه های ابریشمی، نخ اطراف تایر و فیلم های ژاسی)، صنایع کاغذ سازی ( دستمال
کاغذی ، روزنامه، جعبه های مقوایی، کاغذ تحریر و سایر مقواها)، مواد منفجره را می
توان نام برد. اسید سولفوریک در واکنش با اسید نیتریک، یون نیترونیوم
را تولید می کند که در فرآیند نیترودار کردن بسیاری از ترکیبات دیگر استفاده می
شود.
فرآیند
نیترودار کردن در صنایع تولید مواد منفجره مانند تولید تری نیتروتولوئن،
نیتروگلیسیرین و... استفاده می شود.
اسید سولفوریک در انباره های سربی
مانند باتری ماشین به عنوان محلول الکترولیت استفاده می شود. اسید سولفوریک
، یک عامل آبگیری بسیار قوی نیز می باشد.
در اکثر
واکنش ها به عنوان عامل هیدراتاسیون استفاده می شود و در تولید میوه های خشک هم به
میزان کم، از اسید سولفوریک برای جذب آب موجود استفاده می کنند.
از دیگر کاربردهای این اسید میتوان به
کاربرد اسید سولفوریک در باغات پسته با هدف اصلاح شرایط ph خاک
اشاره کرد.
مواد ناسازگار با آن شامل:
1 - اکثر فلزات، اکسید
فلزات، قلیاها، الکل ها، اکسید کننده های
قوی و اسیدها می باشند. اسید سولفوریک حلال اکثر فلزات می باشد و به شدت
خورنده است.
2- در شرایط جوی گرم ممکن
است اسید، فیومها و ذرات التهاب زا و اکسیدهای سمی سولفور در هوا آزاد شوند.
. -در کل اسید سولفوریک
ماده ای است پایدار و فاقد هرگونه پلیمریزاسیون خطرناکی می باشد3
.-اسید سولفوریک باعث
اکسیداسیون، دهیدروژنه شدن و سولفوناسیون ترکیبات آلی می شود4
5 - جهت رقیق نمودن اسید
سولفوریک هرگز آب به اسید اضافه نکنید، چراکه باعث پاشش و جوشش اسید می شود. همیشه
بایستی اسید را اندک اندک به آب اضافه نمود.
در حال حاضر مهمترین روش تولید اسید سولفوریک، تولید از گوگرد عنصری است. دی اکسید گوگرد ممکن است از اکسیداسیون گوگرد خام و یا اکسیداسیون سولفیدهای فلزی گوگرد نظیر سولفید مس، سولفید سرب، سولفید نیکل، سولفیدهای آهن، سولفید روی و یا سولفید مولیبدیم تولید شود.
اکسیداسیون سولفید هیدروژن می شود. (H2S) نیز منجر به تولید دی اکسید گوگرد تبدیل دی اکسید گوگرد به تری اکسید گوگرد در فرایند اکسیداسیون کاتالیستی با کاتالیست سدیم و یا پنتا اکسید وانادیم اصلاح یافته انجام می شود.
در
نهایت از هیدراسیون تری اکسید گوگرد اسید سولفوریک تولید می شود. اصلی ترین روش
تولید تجاری اسید سولفوریک به این صورت است که ابتدا دی اکسید گوگرد از گوگرد تهیه
می شود. سپس دی اکسید گوگرد در فرایند اکسیداسیون کاتالیستی به تری اکسید گوگرد
تبدیل می شود و سپس از واکنش تری اکسید گوگرد با آب اسید سولفوریک غلیظ تولید می
شود.