شیمیدان
شیمیدان
- ۹۵/۰۹/۰۱پیل سوختی
- ۹۵/۰۹/۰۱انواع واکنش های شیمیایی
- ۹۵/۰۹/۰۱واکنش شیمیایی
- ۹۵/۰۹/۰۱معادله شیمیایی
- ۹۵/۰۹/۰۱روشهای جداسازی در شیمی
- ۹۵/۰۹/۰۱مخلوط
- ۹۵/۰۸/۲۰PH
- ۹۵/۰۸/۱۳جدول تناوبی
- ۹۵/۰۸/۱۳مفاهیم پایه شیمی
- ۹۵/۰۸/۱۳شیمی راهنمایی3 تکمیلی سمپاد
مفاهیم پایه شیمی
عنصر چیست؟
این نظریه که هر چیزی در عالم از هزاران ذره ی ریز ساخته شده نخستین بار توسط فلسفه دان یونان باستان، دموکریتوس(460-361ق.م)، مطرح شد. صدها سال گذشت و پیشرفت های عظیم علمی صورت گرفتند تا این نظریه کاملاً بررسی و درک شود. این نظرات اولیه با طرح نظریه ی اتمی ماده در سال 1808 توسط شیمیدان انگلیسی، جان دالتون(1844-1766)، گسترش و ارتقا یافت. نظریه ی دالتون بر این مبنا بود که همه ی مواد از ذرات ریزی به نام اتم تشکیل شده اند و اتم را نمی توان به جزء کوچک تری تقسیم کرد، گرچه نادرستی این امر بعدها ثابت شد. گروهی از اتم های مشابه عنصر را به وجود می آورند. بنابراین عنصر ماده ای است که نمی توان آن را با واکنش شیمیایی به ماده ی ساده تری تجزیه کرد، زیرا فقط از یک نوع اتم ساخته شده است. دالتون اظهار داشت که تمام اتم های یک عنصر مشابه هستند و عناصر شیمیایی مختلف با یکدیگر متفاوتند، زیرا اتم های تشکیل دهنده ی آنها اندکی با هم تفاوت دارند، یعنی تمام اتم های هیدروژن با هلیم متفاوت است، زیرا این دو عنصر از اتم هایی با تفاوت اندک ساخته شده اند، یک شمش طلا تنها از یک نوع اتم ساخته شده، یعنی اتم های طلا. کار دالتون تمام درک کنونی ما از ماهیت اتم را شکل می دهد.
اتم ها از چه ساخته شده اند؟
به دنبال مدل های اتمی گوناگون اولیه توسط جی.جی تامسون (1940-1856) و ارنست رادرفورد (1973-1871)، که هر کدام نارسایی هایی داشتند، رادرفورد مدل اتمی اش را در سال 1911 ارائه داد. به گفته ی رادرفورد، در اتم یک هسته ی مرکزی با بار مثبت وجود دارد که الکترون های دارای بار منفی به دور آن گردش می کنند. وی مدل اتمی خود را برای توضیح نتایج کارهای هانس ویلهلم گایگر (1945-1882) و مارسدن ارائه داد. آزمایش های معدود آنها نشان می داد که ذرات آلفای دارای بیشترین بار مثبت مستقیماً از یک ورق نازک طلا عبور می کنند، اما درصد کمی از آنها منحرف می شوند. رادرفورد دلیل این امر را این گونه بیان کرد: از آنجا که بیشتر اتم را فضای خالی تشکیل می دهد، ذرات آلفا می توانند مستقیماً از آن عبور کنند، اما درصدی از انحراف، وجود یک هسته ی حجیم با بار مثبت را ثابت می کند. ذرات آلفای دارای بار مثبت توسط هسته های مثبت طلا دفع می شوند. به دنبال رادرفورد این موضوع که مرکز اتم شامل هسته ای با بار مثبت و اندازه ی بسیار بزرگ تر نسبت به الکترون های با بار منفی می باشد، مورد قبول همگان قرار گرفت.
پروتون ها و نوترون ها در هسته
ذرات زیر اتمی هسته که به آن بار مثبت می دهند پروتون نامیده می شوند. تا قبل از اینکه بررسی هایی روی هیدروژن و هلیم صورت بگیرد فرض بر این بود که پروتون ها تنها ذرات موجود در هسته اند. این بررسی ها نشان دادند که بار هسته ی هلیم دو برابر، اما جرم آن چهار برابر جرم هسته هیدروژن می باشد. بنابراین چیز دیگری می بایست در هسته وجود داشته باشد که بر جرم تاثیر داشته باشد اما کاری به کار بار نداشته باشد. این ذرات بدون بار نوترون نامیده شدند.
هر عنصری تعداد پروتون های خاص خود را داراست، اگر تعداد پروتون ها تغییر کند آن وقت هسته ی یک عنصر به هسته ی عنصر متفاوتی تبدیل می شود: هیدروژن یک، هلیم دو و لیتیم سه پروتون دارند. به همین دلیل تعداد پروتون ها به عنوان یک عامل شناسنده ی عنصر محسوب و از آن به عدد اتمی یاد می شود. جرم الکترون تقریباً صفر است، اما نوترون و پروتون ها نسبتاً سنگین و دارای جرم یکسان هستند.
ممکن است تعداد نوترون های یک عنصر تغییر کند. این تغییرات در هسته ی اتم، جرم اتم را تغییر می دهد، گرچه عنصر به عنصر دیگری تبدیل نمی شود. پس عنصری که شش پروتون دارد، کربن و آنکه هفت پروتون دارد نیتروژن است. گرچه هسته ای با شش پروتون می تواند شش یا هشت نوترون داشته باشد، مانند کربن-12 یا کربن- 14. بنابراین عدد اتمی عبارت است از تعداد پروتون های هسته. ایزوتوپ های یک عنصر دارای پروتون های برابر و نوترون های نابرابر هستند: 12C و 14C یک عنصر هستند، اما 12C دارای شش نوترون و 14C دارای هشت نوترون می باشد. ایزوتوپ های اورانیم تعداد نوترون های متفاوتی دارند اما عنصر یکسانی هستند. با فروپاشی 238Uتوریم به وجود می آید که عنصر کاملا متفاوتی است. جرم اتمی یک عنصر عبارت است از تعداد پروتون ها و نوترون های موجود در هسته ی یکی از اتم های آنها.
الکترون ها و لایه ها
99/9 درصد حجم یک اتم را فضای خالی تشکیل می دهد، این فضای خالی توسط الکترون هایی که با سرعت در مدارها یا لایه هایی در اطراف هسته گردش می کنند اشغال شده است. برخی اتم ها مثل هلیم فقط یک لایه دارند، در حالی که برخی دیگر همچون کلسیم دارای لایه های متعددی هستند.
رفتار شیمیایی اتم را الکترون های لایه ی آخر تعیین می کنند. اگر لایه ی آخر اتمی با نهایت الکترون هایی که می تواند نگه دارد کامل شده باشد، دیگر نیازی ندارد که برای پر شدن با عناصر دیگر پیوند دهد، چنین عنصری بسیار پایدار است. مثلاً لایه ی آخر آرگون پر است، پس این عنصر پایدار بوده و پیوند های شیمیایی نمی دهد.
اتمی که لایه آخرش کامل نباشد، یعنی شامل بیشترین الکترون های ممکن نباشد، ناپایدار محسوب می شود. این اتم برای اینکه می خواهد لایه ی آخرش را پر کند یک اتم فعال است و به این دلیل با اتم های دیگر پیوند می دهد. تعداد چنین پیوندهایی که اتم می تواند تشکیل دهد ظرفیت آن محسوب می شود.
پیوند کلر و سدیم به توضیح این مطلب کمک می کند. یک اتم سدیم روی هم رفته یازده الکترون دارد، دو تا در لایه ی اول، هشت تا در لایه ی دوم و یکی در لایه ی آخر. این عنصر برای اینکه پایدار باشد باید الکترون لایه ی آخر را از دست بدهد. کلر دارای هفده الکترون است، یعنی هفت الکترون در لایه ی آخر، پس برای پایدار شدن باید یک الکترون بگیرد تا لایه ی آخرش کامل شود. اگر یک الکترون از اتم سدیم به اتم کلر منتقل شود هر دوی این عناصر به آرایش کامل هشت الکترونی در لایه ی آخرشان می رسند. ظرفیت هر دو آنها یکی است. یک پیوند یونی بین دو اتمی که حالا دیگر یون نامیده می شوند صورت می گیرد که به شکل گیری ترکیب یونی کلرید سدیم می انجامد. تعداد الکترون های لایه ی آخر عناصری که در جدول تناوبی در یک گروه قرار دارند یکسان است، به همین دلیل عناصر یک گروه با عناصر دیگر واکنش های مشابهی می دهند.
جرم اتمی نسبی
در سال 1858 استانیز لائو کانیتسارو (1910-1826) لیستی از وزن های اتمی ثابت برای 60 عنصر کشف شده در آن زمان را منتشر کرد که امروزه از آنها به نام جرم های اتمی نسبی یاد می شود. زمانی که عناصر به ترتیب افزایش جرم اتمی نسبی چیده شدند تشابهاتی در خواص شیمیایی آنها در فاصله های ثابت آشکار شد. تا اینکه دمیتری مندلیف (1907-1834) عناصر را به ترتیب افزایش جرم اتمی در کنار هم و عناصری را که رفتارهای مشابهی داشتند زیر هم قرار داد و به این ترتیب جدول تناوبی جدید طراحی شد.
کربن به عنوان ((معیار)) محاسبه ی جرم اتمی نسبی انتخاب شد. برای اتم های کربن-12 جرم اتمی 12 در نظر گرفته شده و جرم های نسبی اتم های دیگر با مقایسه با جرم اتم کربن به دست می آیند. مثلاً اتم های کربن، 12 بار سنگین تر از اتم های هیدروژن هستند، پس جرم اتمی نسبی هیدروژن یک است. اکسیژن 16 بار سنگین تر از اتم های هیدروژن می باشد، پس جرم اتمی نسبی آن 16 می باشد.
مول
جرم اتمی نسبی در بررسی ترکیب ها اهمیت خاصی دارد. با تقسیم کردن جرم عنصر بر جرم اتمی نسبی آن می توانیم به تعداد مول های موجود در یک نمونه پی ببریم. مول از یکاهای دستگاه SI می باشد و عبارت است از تعداد اتم های کربن در 12 گرم از ایزوتوپ کربن-12 ، یعنی 23 10× 6 ذره. یک مول از هر ماده ای 1023 × 6 ذره از آن ماده را در بر می گیرد. این موضوع در آن دسته واکنش های شیمیایی که به نسبت های اتمی دقیق نیاز است بسیار اهمیت دارد. وزن یک مول از یک ماده با جرم اتمی نسبی آن ماده برابر است.
رادیواکتیویته
اتم های یک عنصر تعداد پروتون های معینی دارند. اکثر اتم ها دارای هسته های پایداری هستند که تعداد پروتون ها و نوترون ها در آنها ثابت می ماند. اما برخی هسته ها ناپایدارند و ممکن است شکسته شوند. اتم هایی که هسته های ناپایدار دارند رادیواکتیو می باشند. فروپاشی رادیواکتیو عبارت است از شکسته شدن هسته همراه با آزادسازی انرژی.
هر چه تعداد ذرات زیر اتمی در اتم بیشتر باشد، احتمال اینکه آن اتم رادیواکتیو باشد نیز بیشتر است. سه نوع پرتوزایی وجود دارد: آلفا، بتا، گاما. اتم های بزرگ با پرتو زایی آلفا فروپاشی می کنند. پرتوزایی بتا زمانی رخ می دهد که تعداد پروتون ها و نوترون ها برابر نباشد و می تواند در همه ی عناصر رخ دهد. نوع سوم یعنی پرتوزایی گاما از دو نوع دیگر خطرناک تر بوده و شکل پایدار تری از عنصر را به وجود می آورد. عدد اتمی بیسموت 83 می باشد و این بالاترین تعداد پروتون های ممکن برای پایدار بودن عنصر محسوب می شود. عناصری که عدد اتمی آنها از بیسموت بالاتر است همگی رادیواکتیو هستند.
نیمه عمر
سرعت فروپاشی رادیواکتیو در قالب نیمه عمر اندازه گیری می شود. نیمه عمر زمان مورد نیاز برای فروپاشی نصف هسته های رادیواکتیو در یک ماده ی رادیواکتیو است. نیمه عمر اورانیم- 238، 4/5 میلیارد سال است، اورانیم-238 هر مقدار که باشد چنین زمان طولانی لازم است تا نیمی از هسته های آن به صورت رادیواکتیو فروپاشی کنند. فروپاشی تا زمانی که یک وضعیت پایدار حاصل شود ادامه می یابد. اورانیم با فروپاشی سرب را شکل می دهد. با نگاهی به جدول تناوبی در می یابیم که اورانیم با عدد اتمی 92 فروپاشی می کند و توریم با عدد اتمی 90 را به وجود می آورد. اگر این روند را دنبال کنیم می بینیم که سپس رادیم (88)، رادون (86)، پلونیم (84) و در آخر سرب (82) به وجود می آید. این روند به سرب که می رسد متوقف می شود، زیرا سرب نخستین عنصر با عدد اتمی پایین تر از بیسموت (83) می باشد و همان طور که می دانید 83 حد نهایی تعداد پروتون ها برای پایدار بودن عنصر است. ایزوتوپ هایی که نیمه عمرهای طولانی دارند از آنهایی که سریع فروپاشی می کنند پایدارترند.
برخی از عناصر، مثلاً توریم آن قدر آرام فروپاشی می کنند که رسوب های طبیعی رخ می دهند، برخی دیگر از جمله آنانکوادیم (114) و آنانهگزیم (116) آن قدر فعال هستند که فقط چند هزارم ثانیه قبل از فروپاشی به صورت مصنوعی تولید شده اند.
توضیح جدول تناوبی(جدول تناوبی مندلیف)
در سال 1869 دمیتری مندلیف (1907-1834) نمونه ی جدول تناوبی خود را که مبنای تمام نمونه های امروزی می باشد منتشر کرد. جدول تناوبی نمایشی نموداری از تمام عناصر شناخته شده با یک ترتیب خاص می باشد. می توان تنها با نگاه کردن به جای هر عنصر نسبت به عناصر دیگر در جدول به اطلاعات مهمی دست یافت.
مندلیف عناصر را در جدول تناوبی به ترتیب افزایش جرم اتمی نسبی قرار داد. وی عناصر را در سطرهای افقی (دوره) قرار داد تا عناصری که خواص مشابه داشتند در ستون های عمودی (گروه) ظاهر شوند. او برای اینکه مطمئن شود عناصر با خواص یکسان در یک گروه قرار گرفته اند مجبور بود برخی خانه های جدول را خالی بگذارد. اما این جدول باز هم به این خاطر که دانشمندان را قادر به پیش بینی خواص عناصر جا افتاده می ساخت منبع اطلاعاتی مناسبی بود. بعدها ثابت شد که فرض های مندلیف درباره ی خواص عناصر جا افتاده به طرز شگفت انگیزی دقیق بوده اند.
پیل سوختی
پیل سوختی الکترولیت پلیمر یا غشاء مبادله کننده پروتون
خودرو پیل سوختی
پیل سوختی (به انگلیسی: Fuel cell) یک مبدل انرژی شیمیایی به انرژی الکتریکی است. این تبدیل مستقیم بوده و از بازدهٔ بالایی برخوردار است. معروف ترین نوع پیل سوختی در حال حاضر پیل سوختی هیدروژنی است، که در این مقاله به آن پرداخته می شود. انواع دیگر پیل سوختی مانند پیل سوختی متانول نیز کاربردهای خاصی دارند. در مورد پیل سوختی هیدروژنی میتوان گفت که در این تبدیل از عمل عکس الکترولیز آب استفاده میگردد، به عبارت دیگر از واکنش بین هیدروژن و اکسیژن، آب، حرارت و الکتریسیته تولید میگردد. هر سلول در پیلهای سوختی از سه جزء آنُد، کاتُد و الکترولیت و غشا تشکیل شدهاست.
محتویات
- ۱ مقدمه
- ۲ نحوه عملکرد
- ۳ تاریخچه پیلهای سوختی
- ۴ انواع پیل سوختی
- ۵ مزایا
- ۶ معایب
- ۷ زمینههای مختلف استفاده از پیلهای سوختی
- ۸ بروز ترین روش تولید پیل سوختی
- ۹ مزایای پیل سوختی اکسید جامد
مقدمه
پیلهای سوختی فناوری جدیدی برای تولید انرژی هستند که بدون ایجاد آلودگیهای زیست محیطی و صوتی، از ترکیب مستقیم بین سوخت و اکسیدکننده، انرژی الکتریکی با بازدهی بالا تولید میکنند. تولید مستقیم الکتریسیته بدون محدودیت ترمودینامیکی چرخه کارنو جهت تبدیل انرژی شیمیایی حاصل از سوخت به انرژی گرمایی و مکانیکی و در نهایت الکتریسیته میباشد که اتلاف انرژی را به حداقل مقدار ممکن میرساند و به بازده تئوری بالایی دست پیدا میکنیم. در پیلهای سوختی اکسید جامد سرامیکی (اکسید سرامیک) رسانای یون در الکترولیت است و از اهمیت بسزایی برخوردار است. این پیل در دمای بین ۶۰۰ تا ۱۰۰۰ درجه سانتیگراد کار میکند و با بازده در حدود ۶۰ درصد، توان الکتریکی معادل ۱۰۰ مگاوات دارد. در حال حاضر تعداد زیادی از محققان روی جنبههای مختلف پیل سوختی اکسید جامد، جهت بهبود خواص پیل کار میکنند. برای این کار روی خواص الکترودها و الکترولیت که مهمترین قسمتهای پیل SOFC میباشند را بهینه سازی میکنند و روی عناصر و مواد تشکیل دهنده آنها مطالعه انجام میدهند.
نحوه عملکرد
هر پیل سوختی دارای دو الکترود (آند و کاتد) و یک الکترولیت ما بین این دو الکترود و غشا به منظور جدا کردن دو بخش پیل میباشد. در قطب آند، هیدروژن بر روی یک کاتالیزور واکنش داده و تولید یک یون با بار مثبت و الکترون با بار منفی میکند. پروتون به وجود آمده از محیط الکترولیت گذر کرده حال آنکه الکترون در فضای مدار حرکت میکند و تولید جریان مینماید. در قطب کاتد اکسیژن با یون و الکترون واکنش نشان داده و تولید آب و حرارت مینماید. این سلول به تنهائی ۰.۷ ولت نیروی محرکهٔ الکتریکی تولید میکند که برای روشنایی یک لامپ کوچک کافی میباشد. اگر این پیلها به صورت سری قرار گیرند قادر به تولید برق با توان چندین مگاوات میباشند.[۱] طرز کار پیل سوختی هیدروژنی به شکل انیمیشن در این مرجع نشان داده شده است.[۲]
تاریخچه پیلهای سوختی
تاریخچه این پیلها به دو دوره متمایز تقسیم میشود : دوره اول که حدود صد سال طول کشید، از سال ۱۸۳۹ با ساخت اولین پیل سوختی با الکترولیت اسید سولفوریک توسط آقای گرو آغاز گردید. با تلاش دانشمندان بزرگی مانند جکس، هابر، مون و همکاران و شاگردان آنها منجر به درک علمی از پیل سوختی و شناخت تنگناهای این فناوری تا سال ۱۹۴۰ گردید.
دوره دوم از سال ۱۹۴۰ آغاز میشود که بین سالهای ۱۹۵۰ تا ۱۹۶۰ نمونههای تحقیقاتی متعددی از پیلهای سوختی توسط شرکتهای بزرگی مانند جنرال الکتریک با ظرفیت۰۲/۰ وات الی ۱۵ وات ساخته شد. اما هنوز این ظرفیت برای کاربردهای فنی و صنعتی مورد نظر، کافی و قابل قبول نبود. تا اینکه درسال ۱۹۶۵ یک واحد پیل سوختی با ظرفیت یک کیلووات توسط شرکت جنرال الکتریک به منظور استفاده در ماهواره گمینی۵، ساخته شد و توجه دانشمندان را به خود جلب نمود. این پیل سوختی با ولتاژ ۲۵ ولت و شدت جریان خروجیA ۴۰ آمپر توانست در طول ۷ پرتاب ماهواره گمینی ۵، انرژی برابر با ۵۱۹ کیلووات ساعت طی بیش از ۸۴۰ ساعت پرواز را تامین کند. بدین ترتیب معلوم گردید که پیلهای سوختی میتوانند برای بسیاری از مقاصد هوا - فضا مناسب بوده و انرژی مورد نیاز آنها را به صورت پیوسته و پایدار تامین کنند. این امر موجب گردید تا در سراسر جهان روی توسعة دانش فنی و تکنولوژی ساخت پیلهای سوختی سرمایهگذاریهای بزرگی صورت گیرد. امروزه نیز تحقیقات وسیعی در جهت ارتقاء ظرفیت، کاهش هزینههای ساخت و بهره برداری و توسعة ویژگیهای کاربردی پیلهای سوختی در جریان میباشد. برق خروجی از پیلهای سوختی جریان مستقیم (DC) است. بنابراین برای مصرف کنندههای جریان متناوب از مبدلهای DC به AC استفاده میکنند. از پیلهای سوختی میتوان برای تامین انرژی الکتریکی مورد نیاز در مناطقی که دور از شبکههای سراسری انتقال و توزیع برق هستند و نیز در ایستگاههای ماهوارهای و مخابراتی وغیره نیز به طور رضایتبخشی استفاده نمود .
انواع پیل سوختی
پیلهای سوختی در انواع زیر موجود میباشند: پیلهای سوختی براساس نوع الکترولیت استفاده شده در آنها به پنج نوع اصلی طبقه بندی میشوند.
- پیل سوختی الکترولیت پلیمر یا غشاء مبادله کننده پروتون (PEMFC)
- پیل سوختی قلیایی (AFC)
- پیل سوختی اسید فسفریک (PAFC)
- پیل سوختی کربنات مذاب (MCFC)
- پیل سوختی اکسید جامد (SOFC)
- پیل سوختی میکروبی (MFC)
- پیل سوختی اسید فرمیک (FFC)
- پیل سوختی هوا-روی (Zn-Air FC)
- پیل سوختی سرامیکی
لازم به ذکر است که پیل سوختی متانول مستقیم (DMFC)۶ از خانواده پیل سوختی PEMFC است. پیلهای سوختی بر اساس دمای عملکرد، دارای دامنه دمایی از ۸۰ برای (PEMFC) تا ۱۰۰۰ برای (SOFC) میباشند. پیلهای سوختی دمای پایین (PEMFC ،PAFC ،AFC) دارای حاملهای یونیH+ ویا OH- هستند که انتقال یون از میان الکترولیت وانتقال الکترونها از طریق مدار خارجی را به عهده دارند، و در پیلهای سوختی دمای بالا مانند الکترولیت کربنات مذاب (MCFC) و الکترولیت اکسید جامد (SOFC)، جریان الکتریکی به ترتیب از طریق یونهایCO۳۲- و O۲- انتقال مییابد. در پیلهای سوختی اکسید جامد (SOFC) یا سرامیکی رسانش یون در الکترولیت معمولاً در دمای بین ۶۰۰ تا ۱۰۰۰ درجه سانتیگراد انجام میشود.
مزایا
مزایای پیلهای سوختی بطور کلی عبارتاند از: یل سوختی آلودگی ناشی از سوزاندان سوختهای فسیلی را حذف نموده و تنها محصول جانبی آن آب می باشد.
· در صورتیکه هیدروژن مصرفی حاصل از الکترولیز آب باشد نشر گازهای گلخانه ای به صفر می رسد.
· بدلیل وابسته نبودن به سوختهای فسیلی متداول نظیر بنزین و نفت، وابستگی اقتصادی کشورهای ناپایدار اقتصادی را حذف می کند.
· با نصب پیلهای سوختی نیروگاهی کوچک، شبکه غیرمتمرکز نیرو گسترده می گردد.
· پیل های سوختی راندمان بالاتری نسبت به سوختهای فسیلی متداول نظیر نفت و بنزین دارد.
· هیدروژن در هر مکانی از آب و برق تولید می گردد. لذا پتانسیل تولید سوخت، غیرمتمرکز خواهد شد.
· اکثر پیلهای سوختی در مقایسه با موتورهای متداول بسیار بی صدا هستند.
· انتقال گرما از پیلهای دما پایین بسیار کم می باشد لذا آنها را برای کاربردهای نظامی مناسب خواهد شد.
· زمان عملکرد آنها از باتریهای متداول بسیار طولانی تر است. فقط با دو برابر نمودن سوخت مصرفی می توان زمان عملکرد را دو برابر نمود و نیازی به دو برابر کردن خود پیل نمیباشد.
· سوختگیری مجدد پیلهای سوختی به راحتی امکان پذیر می باشد و هیچگونه اثرات حافظه ای بر جای نمیگذارد.
· بعلت عدم وجود اجزای متحرک نگهداری از آنها بسیار ساده می باشد.
· نصب و بهره برداری از پیل های سوختی بسیار ساده و مقرون به صرفه می باشد.
· پیل های سوختی مدولار می باشند یعنی براحتی توان تولیدی از آنها قابل افزایش می باشد.
· این مولدها قابلیت تولید همزمان برق و حرارت را دارند.
· امکان استفاده از سوختهای تجدیدپذیر و سوختهای فسیلی پاک در آنها وجود دارد.
· به میکروتوربین ها متصل می گردند.
· پیل سوختی به تغییر بار الکتریکی پاسخ می دهد.
· پیل سوختی امکان تولید برق مستقیم با کیفیت بالا را دارد.
· دانسیته نیروی بالا دارد. .میزان بازدهی آن ها نسبت به سلول های دیگر بیش تر است.
معایب
- به مواد بیشتر و فرایندهای سریعتری نسبت به دیگر پیلها نیاز دارد.
- ممکن است در مدت طولانی کار، گرما مشکلاتی چون ناسازگاری عناصر و افت انرژی را موجب شود.
- در صورت استفاده از سوخت ناخالص، کار و گرمای بیش از حد موجب رسوب کربن و در نهایت مسمومیت پیل میگردد.
زمینههای مختلف استفاده از پیلهای سوختی
1.حمل ونقل (خودروهای سواری و وسایط نقلیه عمومی): چند نمونه اتوبوس هیدروژنی تولید شرکت بالارد[۳] از سال 2007 در ویسلر کانادا مورد استفاده قرار گرفته اند. اولین مدل تجاری خودرو پیل سوختی توسط هیوندای در سال 2015 به بازار عرضه شده است.[۴] سایر شرکت های عمده خودروسازی نیز نخستین مدل های خودرو هیدروژنی خود را در سالهای 2016 و 2017 به بازار عرضه خواهند کرد.
2.نیروگاهها (نیروگاههای متمرکز و غیرمتمرکز اعم از خانگی، تجاری، صنعتی):پیل های سوختی به دلیل آرام و بی صدا بودن برای تولید برق محله ای گزینه خوبی محسوب می شود. به علاوه کاهش نیاز به گسترش شبکه توزیع برق، از گرمای تولیدی از این نیروگاهها میتوان برای گرمایش و تولید بخار آب استفاده نمود.
3.وسایل الکترونیکی قابل حمل (تلفنهای همراه، رایانههای شخصی و ...)
4.صنایع نظامی: پیلهای سوختی که در دمای پایین کار میکنند در تانکها، زرهپوش و خودروهای نظامی استفاده میشوند. نداشتن قطعه متحرک دراین نوع پیل های سوختی باعث کاهش صدا شده و به دلیل کارکرد در حرارت پایین ردیابی آنها مشکل تر از خودروهایی با موتور درون سوز می باشد.
بروز ترین روش تولید پیل سوختی
در حال حاضر، پیلهای سوختی، شبیه به خودروها تولید میشوند؛ یعنی قطعات مختلف آنها به صورت جداگانه ساخته و سپس روی هم اسمبل میشوند تا یک پیل سوختی تولید شود. این روند تولید، مراحل بسیار زیادی دارد و در عین هزینه بالای آن، زمان بسیار زیادی صرف تولید آن می شود. گروه تحقیقاتی تامپسون با استفاده از فرایند پیشرفته میکروفابریکیشن، نسل جدید پیلهای سوختی را تولید می کند. در این فرایند به جای تولید جداگانه پیل سوختی، آنها به صورت لایه لایه ساخته میشوند، روشی که هم اکنون برای ساخت ابزارهای میکروالکترونیک مورد استفاده قرار میگیرد. پژوهشگران دانشگاه میشیگان امیدوارند با استفاده از این فناوری ارزان قیمت و همچنین استفاده از مواد ارزانتر، قیمت پیلهای سوختی را از ۱۰ هزار دلار برای هر کیلو وات به ۱۰۰۰ دلار برسانند.
مزایای پیل سوختی اکسید جامد
- به علت عملکرد دمایی بالا دارای بیشترین راندمان نسبت به سایر پیلهای سوختی میباشد.
- از گرمای تولید شده میتوان برای افزایش بازدهی مجدد استفاده نمود.
- امکان بازسازی درونی سوخت به خاطر عملکرد دمایی بالا وجود دارد.
- نیازی به کاتالیستهای گران قیمت ندارد.
- برای استفاده از سوختهای مختلف نیازی به مبدلهای سوخت نیست.
- از آنجاییکه پیل سوختی اکسید جامد دارای الکترولیت جامد است مشکل خوردگی مواد کم میباشد .
- برای ساخت اجزای پیل میتوان از فناوری لایه نازک استفاده نمود. ولی در پیلهای سوختی با الکترولیت مایع چنین امری دست نیافتنی است.
پیل سوختی اساساً وسیله ای است که سوخت (مانند هیدروژن، متانول، گاز طبیعی، بنزین و...) و اکسیدان (مانند هوا و اکسیژن) را به برق، آب و حرارت تبدیل میکند. به عبارت دیگر پیل سوختی شبیه یک باتری بوده ولی بر خلاف باتری نیاز به انبارش (شارژ) ندارد. تا زمانی که سوخت و هوای مورد نیاز پیل تأمین شود، سیستم کار خواهد کرد. پیلهای سوختی میتوانند سوختهای حاوی هیدروژن مانند متانول( Methanol )، اتانول ( Ethanol) ، گاز طبیعی ( Natural Gas ) و حتی بنزین و گازوئیل را مورد استفاده قرار دهند. بطورکلی در سوختهای هیدروکربوری، هیدروژن توسط یک دستگاه اصلاحگر سوخت ( Fuel Reformer )، از آنها جدا شده و بکار گرفته میشود. پیلهای سوختی در کاهش آلودگی محیط زیست نقش بسزائی داشته و بخاطر عدم بکارگیری قطعات مکانیکی زیاد، ایجاد آلودگی صوتی نیز نمینماید. علاوه بر آن سیستم پیل سوختی از کارایی نسبتاً بالائی نسبت به موتورهای احتراق درونسوز برخوردار است. بحران انرژی در سالهای ۱۹۷۳ و ۱۹۹۱ و آلودگی فزاینده محیط زیست، کشورهای صنعتی را بر آن داشت تا جهت استفاده از سیستمهایی با راندمان بالا و سازگار با محیط زیست سرمایه گذاری کلانی نمایند. سیستمهای پیل سوختی از جمله تکنولوژیهای پیشرفته ایست که مصارف غیر نظامی آن با توانهای میلی وات تا مگا وات موضوع تحقیق شرکتهای تولید نیرو، خودرو سازی و نیز شرکتهای نفتی قرار گرفتهاست. پیل سوختی مجموعهای از الکترولیت، الکترودها و صفحات دو قطبی است. در پیل سوختی(بهعنوان مثال نوع الکترولیت پلیمر جامد)، هیدروژن از آند و اکسیژن از کاتد وارد میشوند. هیدروژن الکترون خودرا در آند از دست داده و بصورت پروتن از طریق الکترولیت به سمت کاتد حرکت میکند. الکترون نیز از طریق مدار خارجی به سوی کاتد هدایت میشود. اکسیژن با دریافت الکترون و پروتون به آب تبدیل میشود. حرکت الکترون از آند به کاتد جریان برق را به وجود میآورد که قابل استفاده در وسایل برقی است .آب حاصل در کاتد میتواند مورد استفاده مجدد قرار گیرد.
انواع واکنش های شیمیایی

در این مقاله با انواع واکنش های شیمیایی آشنا شده و در پایان می توانید با توجه به معادله ی شیمیایی هر واکنش، نوع واکنش را تشخیص دهید.
واکنش های شمیایی زیادی تاکنون شناخته شده است؛ به خاطر شباهتی که بسیاری از واکنش های شیمیایی به هم دارند آن ها را به 5 دسته اصلی طبقه بندی می کنند.
1- سوختن: به واکنش سریع مواد با اکسیژن گفته می شود که با آزاد شدن انرژی (به صورت نور و گرما) همراه باشد.
2- ترکیب (سنتز): واکنشی که در آن دو یا چند ماده ترکیب شده و فرآورده (فرآورده های ) جدید و پیچیده (ترکیبی که تعداد و نوع اتم هایش بیشتر است.) تولید می کنند.
3- تجزیه: واکنشی که در آن یک ماده به مواد ساده تر تبدیل می شود.
4- واکنش های جابجایی (ساده): واکنشی که در آن یک عنصر با یک ماده ی مرکب واکنش داده و یک عنصر جدید در فرآورده آزاد می شود و ماده ی مرکب جدید حاصل می شود.
5- واکنش های جابجایی دو گانه: واکنش بین دو ماده مرکب که در فراورده دو ماده مرکب جدید ایجادشود.
در این قسمت، سعی داریم نکات کوچکی در رابطه با این دسته بندی ها ارائه دهیم.

سوختن: برخی از واکنش های سوختن به شرح ذیل می باشند.
انرژی + آب + دی اکسید کربن  گاز اکسیژن + هیدرو کربن( a
گاز اکسیژن + هیدرو کربن( a
شایان ذکر است که اگر سوختن هیدرو کربن ها کامل نباشد، بجای دی اکسید کربن، دوده c)) و مونو اکسید کربن تولید خواهد شد.
انرژِی + اکسید نافلز  گاز اکسیژن + نافلز (b
گاز اکسیژن + نافلز (b
اکسید های نافلزی به اکسید اسیدی نیز مشهورند. این اکسیدهای نافلزی هنگامی که با آب واکنش می دهند، اسید تولید می کنند.
انرژِی + اکسید فلز  گاز اکسیژن + فلز (c
گاز اکسیژن + فلز (c
فلزات گروه های IA و IIA بجز برلیوم، از واکنش پذیری بالایی برخوردارند. این فلزات هنگامی که با اکسیژن سریع واکنش دهند و گرما و نور تولید کنند؛ سوختن است. ولی اگر به آرامی با اکسیژن واکنش دهند، در این حالت مبادله ی انرژِی احساس نمی شود و واکنش اکسایش نام دارد و سوختن نیست. (مانند زنگ زدن آهن)
اکسید های فلزی به اکسید بازی نیز شهرت دارند، هنگام واکنش این مواد با آب، باز تولید می شود.
ترکیب (سنتز): برخی از واکنش های ترکیب در دسته بندی های متفاوت در این قسمت آورده شده است:
a) بسپارش (پلیمر شدن مواد): طی این واکنش، هزارها مولکول کوچک با هم ترکیب شده و مولکول های درشتی به نام پلیمر تولید می کنند.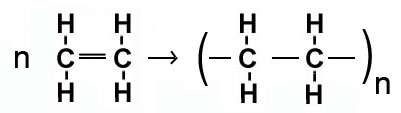
b) واکنش گاز آمونیاک و هالیدهای هیدروژن که منجر به تولید هالید آمونیوم است نیز از جمله واکنش های ترکیب است.
c) واکنش اکسید نافلز در آب نیز نوعی ترکیب است.
اسید اکسیژن دار  آب + اکسید نافلز
آب + اکسید نافلز
این واکنش ها، جزء واکنش های اکسایش نیستند؛ زیرا در این واکنش ها، عدد اکسایش اتمها تغییر نمی کند.
d) واکنش اکسید فلز در آب نیز نوعی ترکیب است.
باز → آب + اکسید فلز
تجزیه: برخی از واکنش های تجزیه در دسته بندی های متفاوت در این قسمت آورده شده است.
a) تجزیه بی کربنات فلزها که واکنش کلی آن ها به صورت زیر است.
بخار آب + دی اکسید کربن + کربنات فلز  بی کربنات فلز
بی کربنات فلز
تنها فلزهای گروه IA در واکنش فوق شرکت می کنند.
b) تجزیه کربنات فلزها که معادله کلی واکنش شیمیایی آن به صورت زیر است.
دی اکسید کربن + فلز اکسید  کربنات فلز
کربنات فلز
شایان ذکر است که کربنات فلزهای گروه IA به جز کربنات لیتیم، وقتی حرارت داده شوند، ذوب می شوند و تجزیه نمی شوند.
c) تجزیه نیترات فلز که معادله کلی واکنش شیمیایی آن ها در دو شرایط متفاوت به شرح ذیل است.
گاز اکسیژن + نیترات فلز  نیترات فلز
نیترات فلز
گاز اکسیژن + گاز نیتروژن + اکسید فلز  نیترات فلز
نیترات فلز
d) تجزیه کلرات فلز به معادله شیمیایی
گاز اکسیژن + کلرید فلز کلرات فلز
کلرات فلز
کلرات ها شامل آنیون CLO3- هستند
.
e) تجزیه سولفات فلز به معادله ی شیمیایی
تری اکسید گوگرد + اکسید فلز  سولفات فلز
سولفات فلز
که سولفات ها شامل آنیون SO4-2 می باشد.
f) تجزیه الکتریکی نمک مذاب آب به معادله ی شیمیایی کلی
عنصرهای سازنده  تجزیه الکتریکی نمک مذاب
تجزیه الکتریکی نمک مذاب
هیدروژن + اکسیژن  تجزیه الکتریکی آب
تجزیه الکتریکی آب
واکنش شیمیایی
واکنش شیمیایی (به انگلیسی: Chemical reaction) فرایندی است که در آن ساختار ذرههای تشکیل دهندهٔ مواد اولیه دچار تغییر میشود؛ یعنی طی آن یک یا چند ماده شیمیایی به یک یا چند ماده شیمیایی دیگر تبدیل میشود.
محتویات
انواع تغییرات مواد
تغییراتی که در واکنشی بر روی مواد واکنشدهنده صورت میگیرد، بطور کلی به دو نوع تغییرات فیزیکی و شیمیایی تقسیم میشوند.
تغییرات فیزیکی
در تغییرات فیزیکی فقط حالت فیزیکی ماده تغییر مییابد نه ساختار ذرههای تشکیل دهنده ماده؛ بنابراین تغییرات همهٔ حالات ماده مانند ذوب، انجماد، تبخیر، میعان، تصعید و چگالش و همچنین انحلال نمکها و بازها در آب، تغییر فیزیکی هستند.
تغییرات شیمیایی
در تغییرات شیمیایی اتصال اتمها به یکدیگر و آرایش الکترونی آنها در واکنشدهندهها تغییر مییابد. البته در یک واکنش شیمیایی، اتمها نه بهوجود میآیند و نه از بین میروند و تنها ترکیب، تجزیه یا بازآرایی میشوند. واکنش شیمیایی بیان یک تغییر شیمیایی است که ممکن است با آزاد کردن انرژی به صورت گرما، نور یا صوت همراه باشند و تولید گاز، تشکیل رسوب یا تغییر رنگ در پی داشته باشند.
روی دادن تغییر فیزیکی و تغییر شیمیایی بطور متوالی
مواردی وجود دارد که هر دو تغییر فیزیکی و شیمیایی بر روی یک پدیده، بطور متوالی اتفاق میافتند. برای نمونه، با حرارت دادن تکهای قند در لوله آزمایش، ابتدا قند ذوب میشود که یک پدیدهٔ فیزیکی است. سپس به رنگ قهوهای در میآید که نشاندهندهٔ شروع تبدیل قند به کربن و یک پدیدهٔ شیمیایی است. در ادامه مقداری بخار آب به بالای لوله میرسد که نشانهٔ تجزیهٔ قند و ادامهٔ پدیدهٔ شیمیایی پیشین است. سپس قطرههای آب روی دیوارهٔ لولهٔ آزمایش پدیدار میشود که نشاندهندهٔ میعان بخار آب آزاد شده و یک پدیدهٔ فیزیکی است. در پایان، در لوله مادهای سیاه رنگ، بیمزه و نامحلول در آب (برخلاف قند اولیه) باقی میماند که این ماده ذغال است و با توجه به تغییر رنگ، مزه و قابلیت حلالیت آن در آب نشاندهندهٔ وقوع یک پدیدهٔ شیمیایی است.
انرژی شیمیایی
هر نوع پیوندی میان اتمهای مختلف سازندهٔ مولکولهای یک جسم، نوعی انرژی در انرژی شیمیایی دارد که مقدار آن به نوع اتمها و نحوهٔ قرار گرفتن آنها در مولکول بستگی دارد. در یک واکنش شیمیایی، در واقع اتصال اتمها به یکدیگر در واکنشها تغییر میکند و در نتیجه انرژی شیمیایی فراوردههای واکنش با انرژی شیمیایی واکنشدهندهها تفاوت پیدا میکند.
به عنوان مثال، واکنش گاز کلر با گاز هیدروژن را در نظر بگیریم. گاز کلر از مولکولهای دو اتمی Cl۲ و گاز هیدروژن از مولکولهای دو اتمی H۲ تشکیل شدهاند. فراوردهٔ واکنش، کلرید هیدروژن HCl خواهد بود که در مقایسه با واکنشدهنده، پیوندهای کاملاً متفاوتی دارد و از این رو انرژی شیمیایی آنها متفاوت است.
اکنون این پرسش پیش میآید که با توجه به متفاوت بودن انرژی شیمیایی فراوردهها و واکنشدهندهها و قانون پایستگی انرژی، این اختلاف انرژی چگونه ظاهر میشود؟
تغییرات گرماگیر و تغییرات گرمازا
مطابق قانون پایستگی انرژی در هر واکنش انرژی کل باید ثابت بماند؛ بنابراین در واکنشها، اختلاف انرژی میان فرآوردهها و واکنشدهندهها به صورت گرما ظاهر میشود. از این رو، واکنشهایی نظیر واکنشهای سوختن متان که با تشکیل کلرید هیدروژن در آنها، سطح انرژی فرآوردههای واکنش از مواد واکنشدهنده پایینتر باشد، به علت تولید انرژی گرمایی، گرمازا میگوییم و در مقابل واکنشهایی که در آنها سطح انرژی شیمیایی فرآوردهها بیشتر از واکنشدهندهها باشد، واکنشهای گرماگیر نامیده میشوند و برای انجام چنین واکنشی باید مقداری گرما به اجزای واکنشدهنده داده شود، مانند تجزیه کردن کلرید آمونیوم جامد که با گرم کردن، به دو گاز آمونیاک و کلرید هیدروژن تبدیل میشود.
بنابراین در اندازهگیری و محاسبهٔ انرژی واکنشهای شیمیایی، چیزی که همیشه محسوس و قابل اندازهگیری است، تفاوت محتوای انرژی یا به عبارتی سطح انرژی مواد اولیه و محصولات عمل است که معمولاً به تغییر محتوای گرمایی، تغییر آنتالپی گفته میشود و با ΔH نمایش میدهند و در یک واکنش گرمازا داریم:
H1: سطح انرژی مواد واکنش دهنده
H2: سطح انرژی مواد حاصل
H2 <H1 H2-H1<0
به این ترتیب تغییر آنتالپی ΔH در یک واکنش انرژیده، منفی است.
در یک واکنش گرماگیر داریم:
H2>H1→H2-H1>0→ΔH>0
پس تغییر آنتالپی، ΔH در یک واکنش انرژیگیر، مثبت است.
واکنشهای شیمیایی برگشتپذیر و برگشتناپذیر
واکنشهای برگشتناپذیر
در این قبیل واکنشها، محصولات واکنش برهم اثر شیمیایی ندارند. به همین دلیل واکنش فقط در جهت رفت انجام میگیرد و تا مصرفشدن کامل واکنشدهنده پیش میرود. مثلاً اگر تکهای نوار منیزیم را در ظرف محتوی HCl وارد کنیم، واکنش شدیدی میان منیزیم و اسید رخ میدهد و کمکم در اسید حل و ناپدید میشود و همزمان با ناپدیدشدن فلز، حبابهای گاز هیدروژن درون اسید به چشم میخورند که از ظرف خارج میشوند.
بنابراین این واکنش یکطرفه است و فقط در جهت رفت پیش میرود. یعنی اگر مقداری گاز هیدروژن را در محلول کلرید وارد کنیم، هیچ واکنشی انجام نمیگیرد.
Mg + 2HCl → MgCl2 + H2
علاوه بر واکنش بالا سوختن انواع سوختها مانند بنزین، نفت، گاز طبیعی و... در مجاورت هوا، محکم شدن تدریجی سیمان، پختن تخم مرغ، مچاله شدن نایلون در برابر شعله، نمونههایی از واکنشهای برگشتناپذیرند.
واکنشهای برگشتپذیر
این واکنشها در شرایط مناسب در هر دو جهت رفت و برگشت پیش میروند، مثلاً اگر بخار آب را از روی گرد آهن داغ عبور دهند، اکسید آهن همراه با گاز هیدروژن پدید میآید.
(3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g
و اگر گاز هیدروژن را بر اکسید آهن (Fe3O4) عبور دهند، آهن و بخار آب تولید میشود. واکنش برگشت: (Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l
واکنش رفت و برگشت در مجموع یک واکنش برگشتپذیر را تشکیل میدهند. در نتیجه واکنش اثر بخار آب بر آهن داغ برگشتپذیر است. در زندگی با موارد زیادی از واکنشهای برگشتپذیر برخورد میکنیم، مانند شارژ دوبارهٔ باتری اتومبیل. مواد شیمیایی موجود در باتری خودرو هنگام تولید جریان برق به تدریج مصرف شده و به مواد دیگری تبدیل میشود. با شارژ مجدد باتری، واکنشهای برگشت انجام میگیرند و مواد اولیه پدید میآیند.
مثالهایی از فرایندهای شیمیایی
همانطور که در پیش گفته شد، در تغییر شیمیایی ماهیت شیمیایی مواد تغییر مییابد و فراوردههای جدید با خواص متفاوت از مواد اولیه تولید میشود؛ بنابراین پدیدههای زیر نمونههایی از تغییرهای شیمیایی هستند:
- سوختن انواع سوختها. مانند بنزین، نفت، گاز طبیعی و... در مجاورت هوا
- زنگ زدن فلزات
- گوارش غذا
- رسیدن میوه
- پختن غذا
- فساد مواد
- سفت شدن تدریجی سیمان
- انحلال آمونیاک در آب. زیرا در اثر انحلال، قسمتی از مولکولهای آمونیاک با مولکولهای آب ترکیب شده و مادهٔ جدیدی به نام هیدروکسیدآمونیوم تولید مینمایند. به همین دلیل که واکنش شیمیایی بین حلال و حل شونده رخ میدهد، حل شدن بیشتر جنبهٔ شیمیایی دارد.
- لخته شدن مواد کلوئیدی. در اثر لخته شدن پیوندهای جدیدی تشکیل میگردد که باعث تجمع مولکولهای یک محلول کلوئیدی میشود.
- ایجاد گاز (اکسیژن) در اثر حرارت اکسید جیوه
معادله شیمیایی
معادله شیمیایی نمایش دهنده یک واکنش شیمیایی بر اساس نماد های شیمیایی اجزا شرکت کننده در واکنش می باشد.مواد اولیه شرکت کننده در واکنش، واگنشگر نام دارد و در سمت چپ معادله شیمیایی نوشته می شود و مواد تولید شده در واکنش را فرآرده می نامند و در سمت راست معادله نوشته می شود.بر اساس قانون بقای جرم ماده به وجود نمی آید و از بین نیز نمی رود، در نتیجه با قرار دادن ضرایبی در پشت نماد های شیمیایی اجزا اصطلاحا آن معادله را موازنه می کنیم.این ضرایب ،ضرایب استوکیومتری نام دارد.
شکل کلی یک معادله شیمیایی
- (aA + bB
cC + dD)
که در این معادله (A،B،C،D)نشان دهنده نماد شیمیایی اجزا تشکیل دهنده واکنش است و(a،b،c،d) نیز ضرایب استوکیومتری آن ها است.
همچنین در معادلات شیمیایی برای نشان دادن حالت ماده (جامد، مایع، گازو...) از علائم زیر استفاده می شود:
به عنوان مثال واکنش نیترات نقره و کلسیم کلرید:
-
- CaCl۲(aq) + ۲AgNO۳(aq)
Ca(NO۳)۲(aq) + ۲AgCl(s)
- CaCl۲(aq) + ۲AgNO۳(aq)
جداسازی
جداسازی یکی از شاخههای اصلی شیمی تجزیه و مهندسی شیمی است. سه شاخه مهم دیگر در شیمی تجزیه الکتروشیمی، طیفسنجی و به تازگی کمومتریکس است. در جداسازی شیمی تجزیه، به روش های گوناگونی بافت و آنالیت را از هم جدا میکنند.
محتویات
[نهفتن]
- ۱ روشهای فیزیکی و شیمیایی جداسازی
- ۱.۱ تقطیر (مختص مهندسی شیمی)
- ۱.۲ استخراج (مختص مهندسی شیمی)
- ۱.۳ کروماتوگرافی (مختص شیمی تجزیه)
- ۱.۴ الکتروفروز (مختص شیمی تجزیه)
- ۲ جستارهای وابسته
- ۳ منابع
روشهای فیزیکی و شیمیایی جداسازی
روشهای گوناگونی وجود دارد. تعدادی از آنها عبارتند از:
تقطیر (مختص مهندسی شیمی)
تقطیر نام روشهایی است که بر اساس تفاوت در توزیع ماده بر اساس فشار بخار در فاز بخار و مایع، دو یا چند ماده را از هم جدا میکنند. به روشهای مختلفی چون تقطیر ساده، تقطیر در خلا، تقطیر جزء به جزء، تقطیراستخراجی، تقطیر آزئوتروپی و تقیر با بخار آب صورت میگیرد.
استخراج (مختص مهندسی شیمی)
استخراج یکی از قدیمیترین روشهای جداسازی میباشد. استخراج کافئین از برگ چای نمونهای از استخراج است. در استخراج اساس کار بر توزیع ماده میان دو (و اخیرا سه) فاز است. استخراج مایع - مایع، استخراج با جاذب، ریزاستخراج با فاز جامد و قطره تعدادی ازاین روشهاست.
کروماتوگرافی (مختص شیمی تجزیه)
کروماتوگرافی یکی از قدرتمندترین روشهای کنونی جداسازی است. در این روش یک فاز متحرک و یک فاز ساکن وجود دارد. ماده میان دو فاز توزیع میشود و به مرور زمان در بستر کروماتورگرافی یا ستون کروماتوگرافی حرکت میکند تا به آشکارساز برسد. تعداد روش های کروماتوگرافی بسیار زیاد است. چند نمونه از آن ها عبارتند از کروماتوگرافی گازی، کروماتوگرافی مایع، کروماتوگرافی کاغذی، کروماتوگرافی طردی.
الکتروفروز (مختص شیمی تجزیه)
الکتروفروز بیشتر برای نمونههای بیوشیمی کاربرد دارد و بر اساس اعمال پتانسیل الکتریکی و و تفاوت در سرعت حرکت یونها استوار است.
مخلوط
مخلوط به معنی آمیخته شدن دو ماده یا همان شوریده می باشد.[۱] در شیمی، مخلوط کردن دو یا چند ماده مختلف که با یکدیگر ترکیب می شوند را مخلوط می گویند، اما نه آنگونه که ترکیب شیمیایی بوجود آمده باشد.مخلوط اشاره ای است به ترکیب فیزیکی دو یا چند ماده که هویتشان (هرچند به سختی قابل تشخیص می باشد) باقیمانده است.
مخلوط، محصول ترکیبات فیزیکی و یا ترکیب مواد شیمیایی است به گونه ای که بعد از مرحله ترکیب عناصر، ترکیبات شیمیایی یا فیزیکی به تغییرات شیمیایی دیگر تبدبل نمیشوند و خواص اولیه خود را حفظ می کنند.[۲] به رغم تغییر نکردن خاصیت شیمیایی این ساختار، ممکن است از لحاظ فیزیکی تغییر کند، از جمله این تغییرات می توان تغییر خاصیت نقطه ذوب مواد را نام برد. شما میتوانید باامیختن مواد مختلف با هم انواع گوناگونی از مواد مخلوط یا نا خالص به حالت جامد ، مایع و گاز درست کنید. مخلوط ها میتوانند مایع در مایع ، گاز در گاز ، جامد در جامد ، گاز در جامد ، جامد در گاز ، جامد در مایع و گاز در مایع باشند.
مخلوط را می توان به دو گونه همگن یا ناهمگن نام گذاری کرد.در مخلوط همگن، تمامی مواد به صورت یکسان با یکدیگر ترکیب می شوند و مخلوطی یکدست و غیر قابل تشخیص (به صورت چشمی) به دست می آید. اما در مخلوط ناهمگن نوع مواد و ترکیباتی که در آن استفاده شده است را به راحتی می توان مشخص کرد و در آن، مواد به صورت کامل با یکدیگر مخلوط نشده اند.
عناصر و موادی که باعث ایجاد مخلوط همگن می شوند عبارتند از: مخلوط اکسیژن و نیتروژن، شکر، نمک، و بسیاری از مواد حل شونده در آب، مخلوطی همگن هستند به گونه ای که مواد به صورت یکدست در آن حل می شوند.
|
||||||||||||||||||
پیاچPH
از ویکیپدیا، دانشنامهٔ آزاد
|
پی اچ چند ماده معروف[۱] |
|
|
ماده |
pH |
|
اسید کلریدریک، ۱۰M |
-۱٫۰ |
|
۰٫۵ |
|
|
۱٫۵ – ۲٫۰ |
|
|
۲٫۴ |
|
|
۲٫۵ |
|
|
۲٫۹ |
|
|
۳٫۵ |
|
|
۴٫۰ |
|
|
۴٫۵ |
|
|
<۵٫۰ |
|
|
۵٫۰ |
|
|
۵٫۵ |
|
|
۶٫۰ |
|
|
۶٫۵ |
|
|
۷٫۰ |
|
|
آب دهان فرد سالم |
۶.۵ – ۷٫۴ |
|
۷٫۳۴ – ۷٫۴۵ |
|
|
۷٫۷ –۸٫۳ |
|
|
۹٫۰ – ۱۰٫۰ |
|
|
۱۱٫۵ |
|
|
۱۲٫۵ |
|
|
۱۳٫۵ |
|
پیاچ یا پ هاش (به انگلیسی: pH، مخفف potential of hydrogen) یک کمیت لگاریتمی است که میزان اسیدی یا بازی بودن مواد را مشخص میکند. بیشتر آبزیان فقط در پیاچ بین ۵ تا ۹ زنده میمانند.[۲]
تعریف و تاریخچه[ویرایش]
بررسی غلظت یون هیدروژن در اواخر سده نوزدهم برای برخی از صاحبان صنایع شیمیایی اهمیت ویژهای پیدا کرد. به عنوان مثال غلظت یون هیدروژن در طول فرایند تخمیر و فعالیت مخمرها اثر میگذارد و لازم است که غلظت یون هیدروژن دایماً مورد بررسی قرار گیرد. از طرفی چون غلظت یون هیدروژن معمولاً عددی بسیار کوچک است و کار کردن با آن دشوار است، نخستین بار سورِن سِن دانشمند دانمارکی در سال ۱۹۰۹ میلادی مقیاسی به نام pH را بنا کرد. بنا به تعریف، pH برابر منفی لگاریتم مبنای ۱۰ غلظت مولی یون هیدروژن فعال در محلول است.[۳]
- در دمای اتاق(pH (۲۹۸Kآب خالص را ۷ در نظر میگیریم. زیرا در این دما غلظت یون هیدرونیم در آب خالص برابر۷-۱۰است.
- در دمای اتاق(۲۹۸K) گسترهٔ بازهٔ pH از (۱۴ ~ ۰) است. عدد صفر اسیدی ترین محیط و عدد ۱۴ بازی ترین محیط را مشخص میکند. در چنین دمایی، محلولی با pH = ۷ خنثی در نظر گرفته میشود.
- با بالا بردن دما، گسترهٔ بازهٔ pH کمتر میشود. برای مثال در دمای ۳۵۸K این بازه به (۱۳~۰) تغییر میکند. در نتیجه در چنین دمایی، محلولی با pH=۶٫۵ را خنثی فرض خواهیم کرد.
شرایط
- ماده باید مایع (l)یا محلول آبی (aq) یا محلول غیرآبی (sol) باشد.
- پی اچ معمولاً در دمای اتاق (۲۹۸K) سنجیده میشود.
شناساگرها (Indicators)
شناساگرها در محیطهای اسیدی یا بازی به رنگهای متفاوتی درمی آیند. از شناساگرها برای تعیین pH محلولها استفاده میشود.
·
- از جمله شناساگرهای معروف میتوان به موارد زیر اشاره کرد:
- گلبرگ گل سرخ
- کاغذ تورنسل (لیتموس) که از درخت لیتموس به دست میآید.
- محلول فنول فتالئین (که اگر در یک محلول بازی ریخته شود به سرعت رنگ محلول را ارغوانی میکند)
- محلول متیل اورانژ (متیل نارنجی)
- محلول متیلن بلو
-استفاده از شناساگرهای شیمیایی وقت گیر و همراه با اشتباه در تعیین دقیق pH است؛ از این رو امروزه از pH سنج دیجیتالی استفاده میشود.








